2021年2月10日,四川大学华西医院邵振华教授研究团队,联合山东大学于晓-孙金鹏教授团队,西安交通大学张磊教授团队以及香港中文大学(深圳)杜洋教授在Cell 上发表了题为“Ligand recognition and allosteric regulationof DRD1-Gs signaling complexes”的研究论文,该研究利用单颗粒冷冻电镜技术解析了多巴胺受体DRD1与G蛋白的复合物结构,从而在原子层面上详细阐释了DRD1的配体识别、别构调节及与G蛋白偶联的机制,该项研究将为高血压、帕金森综合症、肾损伤等疾病的药物开发和治疗带来新的曙光。

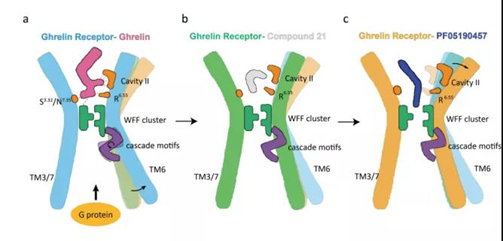
越来越多的GPCRs被报道在缺乏细胞外刺激的情况下表现出高的基础或组成活性。GPCRs的自发本第活性与人类生理功能和各种疾病有关。因此,反向激动剂与激动剂和中性拮抗剂一起被发现是一种新的配体类型。在药理学中,反向激动剂与受体的正位位点结合,降低受体的组成活性,引起与激动作用完全相反的作用,导致GPCR药理学领域的范式转移。因此,了解GPCRs的组成活性和反向激动作用的机制将有助于开发新的治疗药物。Ghrelin受体,又称生长激素促分泌素受体(GhsR),属于A类GPCRs的β-分支,具有结构性活性(50%的活性不依赖于内源性配体Ghrelin)。Ghrelin受体具有广泛的生理功能,包括食欲调节、酒精消耗、脂肪细胞代谢和葡萄糖稳态,这是因为它分布广泛,并通过不同的G蛋白偶联或β-arrestin募集的多种信号通路。内源性Ghrelin激动剂是一种由28个氨基酸组成的肽,主要由胃分泌,由于Ghrelin的非酰化形式根本不结合或激活Ghrelin受体,因此Ghrelin的生物学作用需要对Ser+3残基上的羟基进行酰化修饰(通常是辛酰基)。此外,与体内常见的辛酰化ghrelin相比,脂肪酸修饰的长度也可以产生不同的激活效力。先前的研究表明,抑制ghrelin-ghrelin受体信号轴和配体的脱酰化或受体的缺失可以潜在地预防肥胖和2型糖尿病(T2d);因此,阻断ghrelin受体已被证明是治疗相关疾病的一种很好的治疗方法。鉴于Ghrelin受体的结构性活性,反向激动剂将成为药理药物的最大有效靶点。到目前为止,来自不同制药公司的几种报道的配体显示出一致的反向激动剂效果。然而,在某些情况下,临床前研究是令人困惑的。PF-05190457是唯一报道的针对Ghrelin受体的小分子反向激动剂,正在进行T2D和酒精中毒治疗的第一阶段临床试验。尽管先前的研究揭示了中性拮抗剂结合的ghrelin受体结构中有一个分叉的口袋,但是ghrelin受体对pf-05190457的分子识别仍然不清楚,从而阻碍了有效的药物开发。在这项研究中,该研究确定了Ghrelin受体与反向激动剂PF-05190457的复合物的晶体结构,以及与内源性Ghrelin偶联的GO异源三聚体的活性Ghrelin受体的冷冻电子显微 (EM)结构。该研究为全面了解与不同类型配体结合的Ghrelin受体的不同构象提供了机会。此外,该研究揭示了反向激动剂与受体结合的独特模式,确定了配体识别的空腔,并破译了反向激动剂和激动剂对Ghrelin受体的作用机制。饥饿素受体与激动剂、中性拮抗剂和反向激动剂的结合模型(图片源自Nature Communications )总之,该研究为Ghrelin受体与激动剂和反向激动剂结合的详细机制提供了深入的见解,并为设计针对Ghrelin受体的特异性配体铺平了道路。https://www.nature.com/articles/s41467-022-27975-9